Влияние спектрального состава света на продукционные характеристики культуры Arthrospira (Spirulina) platensis
Effect of spectral composition of light on the production characteristics of Arthrospira (Spirulina) platensis
Клочкова В.С.1, Богачёва Е.А.1, Лелеков А.С.2
Viktoria S. Klochkova, Elizaveta A. Bogacheva, Alexander S. Lelekov
1Севастопольский государственный университет, (Севастополь, Россия)
2Федеральный исследовательский центр «Институт биологии южных морей имени А.О. Ковалевского РАН»
(Севастополь, Россия)
1Sevastopol State University (Sevastopol, Russia)
2Kovalevsky Institute of Biology of the Southern Seas of RAS (Sevastopol, Russia)
УДК 579.017.8:57.036
Проведено исследование роста накопительной культуры Arthrospira (Spirulina) platensis при различном спектральном составе светодиодного и люминесцентного излучения в плоскопараллельных фотобиореакторах. В опытах использовали светодиодные лампы LCD Feron LB-213 10 Вт, а также люминесцентные лампы TDM Electric 18 Вт. Показано, что максимальная продуктивность A. platensis не зависит от спектра излучения и составляет 0,25 г СВ·л-1·сут-1 при энергии 45 Вт/м2. На линейной фазе роста рассчитана эффективность преобразования световой энергии (КПД фотобиосинтеза) с учётом того, что культура поглощает 90% падающего света: максимальное значение получено для светодиодного и люминесцентного освещения (23 Вт/м2 и 17 Вт/м2 соответственно), оно оказалось одинаковым и составило около 3,78%. Минимальный КПД (2,69%) получен при люминесцентном освещении при 34 Вт/м2.
Ключевые слова: максимальная продуктивность; КПД фотобиосинтеза; удельная скорость роста; спектральный состав.
The study of the growth of the batch culture of Spirulina platensis with different spectral composition of LED and luminescent radiation in plane-parallel photobioreactors was carried out. In the experiments, we used LED lamps LCD Feron LB-213 10 W, as well as fluorescent lamps TDM Electric 18 W. It has been shown that the maximum productivity of A. platensis does not depend on the radiation spectrum and is 0,25 g·l-1·day-1 at an energy of 45 W·m-2. In the linear phase of growth, the efficiency of light energy conversion (efficiency of photobiosynthesis) was calculated, taking into account that the culture absorbs 90% of the incident light: the maximum value was obtained for LED and fluorescent lighting (23 W·m-2 and 17 W·m-2 respectively), which turned out to be the same and amounted to about 3,78 %. The minimum efficiency of 2,69% is obtained with fluorescent lighting at 34 W·m-2.
Keywords: maximum productivity; efficiency of photobiosynthesis; specific growth rate; spectral composition.
Введение
Световая энергия определяет основополагающий процесс в растениях – фотосинтез. Жизнедеятельность растений находится в тесной зависимости от интенсивности и спектрального состава света, т.к. данные факторы регулируют рост и развитие, фотосинтетические процессы и продуктивность растений. Спектр действия фотосинтеза (кривая его зависимости от длины волны падающего света) при выровненном числе квантов имеет два четко выраженных максимума (в красной и синей части спектра), аналогичных максимумам поглощения хлорофилла.
Из всего спектра для жизни растений важна фотосинтетически активная радиация (ФАР), находящаяся в пределах от 380 до 710 нм, и физиологически активная (300–800 нм), но наиболее значимы красные лучи, спектр которых находится в пределах от 600 до 720 нм. Свет этой части спектра является основным поставщиком энергии для фотосинтеза и влияет на процессы, связанные с изменением скорости развития растения. Вместе с тем избыток красной части спектра задерживает процессы образования генеративных органов у высших растений. Синие, фиолетовые (380–490 нм), также красные лучи принимают непосредственное участие в фотосинтезе, стимулируют образование белков и регулируют скорость развития растения (Белянин, 1980).
Свет, падающий на какую-либо систему, производит определённое действие только тогда, когда он поглощается; отражённый, рассеянный или прошедший через систему свет на неё не действует (Хит, 1972). Фотосинтез начинается с улавливания и поглощения света пигментом хлорофиллом, содержащимся в хлоропластах клеток зеленых растений. Все фотосинтезирующие организмы содержат один или несколько органических пигментов, способных поглощать видимый свет, запуская тем самым фотохимический процесс фотосинтеза (Антонов и др., 1999).
Когда свет (квант света) падает на молекулу хлорофилла, то один из ее электронов оказывается в возбужденном состоянии, т.е. переходит на более высокий энергетический уровень. Возбужденные электроны передаются затем другим молекулам, в результате чего повышается свободная энергия молекулы-акцептора, а «брешь», образованная в молекуле хлорофилла, заполняется электроном, поступающим из воды. Последняя при этом окисляется, в результате чего выделяется молекулярный кислород. Хлорофилл является промежуточным соединением на пути электронов от низкоэнергетического уровня в молекулах воды к высокоэнергетическому уровню в конечном акцепторе электронов (Пехов, 2000).
В процессах преобразования энергии квантов света в химическую энергию органических веществ участвуют не все молекулы пигментов, а лишь небольшая их часть, расположенная в особых реакционных центрах фотосистем. Энергия, поглощенная хлорофиллом и вспомогательными пигментами, в частности каротиноидами, передается молекулам хлорофилла, находящимся в этих фотохимически активных центрах (ловушках). Молекулы пигментов, собирающие энергию света, и, прежде всего, хлорофилл а, слегка отличаются одна от другой по спектрам поглощения и действуют по принципу светособирательной антенны. Передача энергии от этих молекул хлорофилла и каротиноидов носит название резонансного переноса. Упаковка таких молекул в гранах хлоропластов очень плотная, что позволяет колебательной энергии непосредственно от одной молекулы пигмента переходить к другой молекуле (Хит, 1972).
Эффективность и направленность миграции энергии по фотосинтетической пигментной матрице зависит как от характера локализации молекул пигмента в пределах данного пигмент-белкового комплекса (ПБК) (т.е. от расстояния между молекулами и их ориентации), так и от взаиморасположения различных ПБК в фотосинтетической мембране. Эти факторы в сочетании с различными условиями светового возбуждения могут привести к тому, что перенос энергии между разными группами пигментов будет происходить по разным физическим механизмам в пределах одной фотосинтетической единицы (Антонов и др., 1999).
При сравнительной оценке различных биотехнологических установок с микроводорослями важнейшими критериями являются наибольшие продуктивности и энергетическая эффективность фотосинтезирующей культуры клеток. Фотосинтез и рост водорослей в большинстве случаев лимитируются световой энергией (ФАР), которая первоочерёдно влияет на все процессы, которые протекают в клетках. Поэтому создание оптимальных световых условий для клеток в культуре представляет одну из первоначальных задач, в решении которой особая роль принадлежит поиску путей и способов, повышающих «захват» действующего лучистого потока слоем суспензии и усвоение водорослями поглощаемой энергии ФАР. Величина поглощаемой лучистой энергии зависит как от оптических свойств взвеси клеток, так и от интенсивности и спектрального состава действующего потока (Белянин, 1980).
Культивирование микроводорослей в условиях естественного освещения является основным способом получения их биомассы в промышленных масштабах, однако это носит сезонный характер: с мая по сентябрь. Но при благоприятных погодных условиях, как световых, так и температурных, продолжительность сезона может быть значительно увеличена (Чекушкин и др., 2019).
В настоящее время использование различных источников света для выращивания фотосинтезирующих организмов в условиях искусственного освещения представляет большой интерес как с точки зрения высокой энергоэффективности осветителей, так и с точки зрения получения оптимального спектрального состава для создания наиболее благоприятных условий для роста и развития растений (Козёл и др., 2015). Среди современных источников искусственного освещения для лабораторных и промышленных задач по выращиванию микроводорослей на первое место выходят светодиоды. Достоинством мощных светодиодов можно отнести невысокую стоимость, разнообразие спектров излучения (Гаврилов и др., 2018; Справочная книга…, 1983). Популярностью также пользуются и люминесцентные лампы, излучаемое освещение которых близко к естественному свету.
Цель работы: исследовать влияние спектрального состава действующего потока светового излучения на продукционные характеристики Arthrospira (Spirulina) platensis.
Материалы и методы
В качестве объекта исследования была выбрана Arthrospira (Spirulina) platensis (Nordst.) Gomont, полученная из коллекции ФИЦ Института морских биологических исследований им. А.О. Ковалевского РАН, г. Севастополь. A. platensis выращивали в унифицированной лабораторной установке (Тренкеншу и др., 2017) на питательной среде Zarrouk (Zarrouk, 1966), фотобиореактор плоскопараллельного типа толщиной 2 см, площадь рабочей поверхности 0,05 м2. В различных опытных вариантах в качестве источника освещения использовали светодиодные лампы LCD Feron LB-213 мощностью 10 Вт, а также холодные люминесцентные лампы Philips Daylight TL-D 54-765 6G мощностью 18 Вт. Освещённость рабочей поверхности фотобиореактора в первой серии опытов составляла 5 клк, во второй – 10 клк. Температура поддерживалась на уровне 28±1°С.
В эксперименте проводили измерение температуры, оптической плотности культуры микроводорослей, а также сухой биомассы. Температуру суспензии измеряли ртутным термометром непосредственно в фотобиореакторе, абсолютная погрешность измерений составляла 0,5°С. Освещённость регистрировали люксметром Ю-116. Отбор проб для определения оптической плотности проводили из разных точек внутри фотобиореактора: отбирали по 5 мл суспензии клеток водорослей, получая таким образом «среднюю пробу» объёмом 30 мл. В средней пробе после перемешивания определяли коэффициент пропускания. Оптическую плотность рассчитывали по формуле: D = -lg(T), где Т – величина пропускания, определяемая на фотометре КФК-2 при длине волны 750 нм, погрешность измерения величины пропускания не превышала 1%. Кюветы располагали максимально близко к фотоприёмнику, что позволяло снизить ошибку измерения оптической плотности культуры, связанную со светорассеянием. При выходе показаний прибора за границы рабочего диапазона (значение пропускания становится меньше 30%), проба разбавлялась дистиллированной водой. Спектр культуры определяли на спектрофотометре Lambda 365 Integrating Sphere. Измерения проводили относительно дистиллированной воды.
Сухую биомассу (СВ) A. platensis определяли методом фильтрации суспензии микроводорослей через бумажные фильтры. Предварительно измерили массу фильтра (0,169 г). Отбирали 100 мл аликвоты (10 проб по 10 мл) и пропускали через фильтровальную бумагу. Промывка осуществлялась дистиллированной водой. Далее бумагу с получившейся пастой культуры помещали в сушильный шкаф при температуре 60оС на 24 часа. После этого измеряли массу фильтра с сухой массой (0,249 г). В результате сухой вес A. platensis составил 0,08 г. На 1000 мл культуры сухая биомасса составила 0,8 г. С помощью уравнения, связывающего биомассу с оптической плотностью (Геворгиз, Алисиевич, Шматок, 2005), определён эмпирический коэффициент k, который равен 0,8 при D=1 ед.опт.плот.
Результаты и обсуждение
В ходе эксперимента получены кривые роста A. platensis при использовании светодиодного и люминесцентного источников излучения.
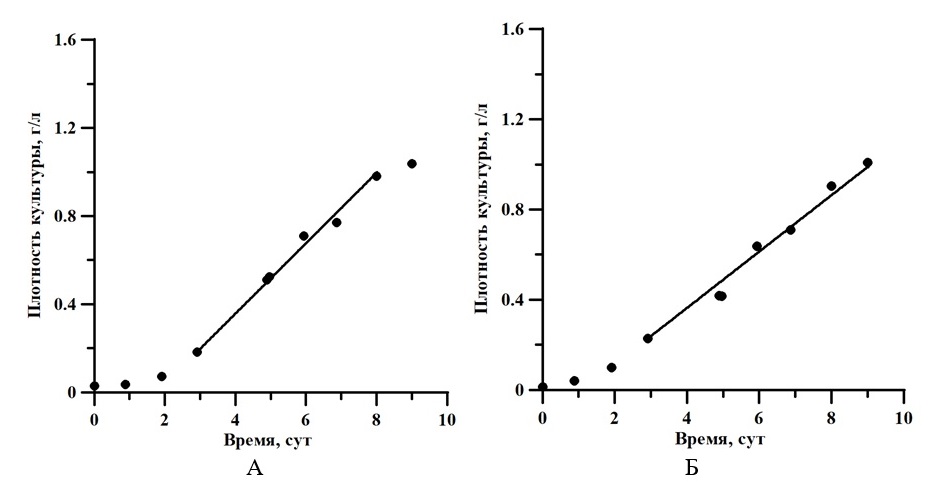
Рис. 1. Кривые роста при светодиодном освещении (А) и при люминесцентном освещении (Б). Освещённость для обоих вариантов составила 5 клк
Fig. 1. Growth curves under LED lighting (A) and under fluorescent lighting (Б). Illumination for both variants was 5 klx
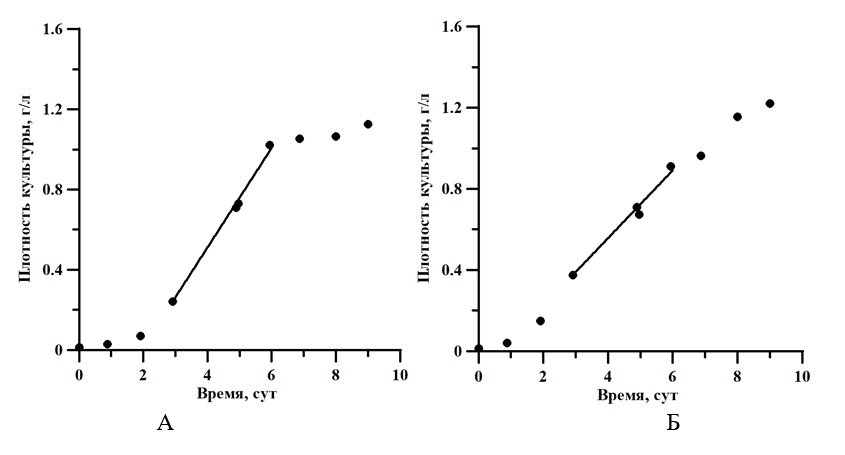
Рис. 2. Кривые роста при светодиодном освещении (А) и при люминесцентном освещении (Б). Освещённость для обоих вариантов составила 10 клк
Fig. 2. Growth curves under LED lighting (A) and under fluorescent lighting (Б). Illumination for both options was 10 klx
Линейная фаза роста характеризуется постоянством максимальной продуктивности культуры Pm, которая, в свою очередь, определяется величиной светового потока на ключевой фермент (Тренкеншу и др., 2018). Аппроксимация линейной фазы роста позволила определить величину Pm, которая составила 0,16 г СВ·л-1·сут-1:
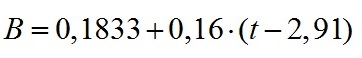
Аналогичные расчёты были проведены для всех опытных вариантов, значения максимальной продуктивности внесены в Таблицу 1.
Таблица 1. Значения максимальной продуктивности культуры A. platensis для различных источников освещения
Table 1. Values of maximum productivity of A. platensis culture for various lighting sources

Известно, что основной энергетической характеристикой роста культуры микроводорослей является КПД фотобиосинтеза или эффективность преобразования световой энергии в энергию химических связей внутри клетки. По определению, КПД фотобиосинтеза есть отношение двух величин: запасённой (Ех) и поглощённой (Еп) световой энергии (Геворгиз, Шматок, Лелеков, 2005):
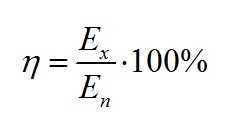 |
(1)
|
Поглощённая энергия зависит от мощности, падающей на рабочую поверхность фотобиореактора или облучённости (Е0), площади (S), времени (t) и коэффициента поглощения энергии клетками микроводорослей (α):
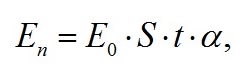 |
(2)
|
где E0 – интенсивность поверхностной радиации, S – площадь рабочей поверхности, t – количество секунд в сутках, α – коэффициент поглощения.
Очевидно, что Е0 определяется спектральной характеристикой источника излучения и для разных вариантов нашего эксперимента будет отличаться. Величина α определяется спектром поглощения непосредственно культуры.
Так как для разных длин волн светового потока величина αsp зависит от спектра культуры (DL(λ)), то необходимо найти сумму всех значений αsp для каждой длины волны из области ФАР чтобы определить коэффициент поглощения (α):
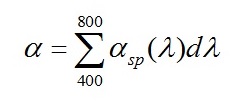 |
(3)
|
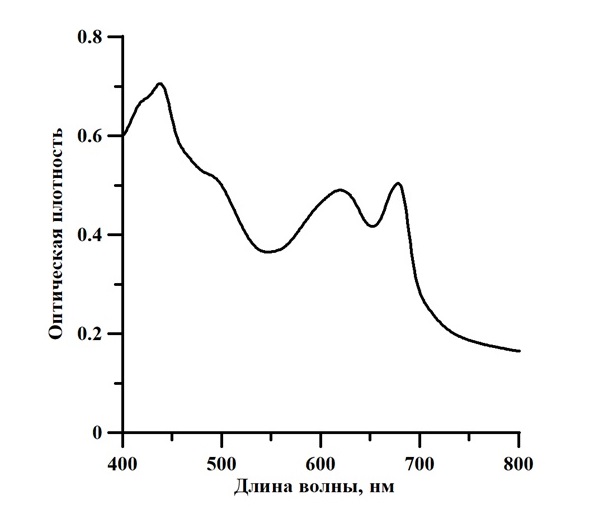
Рис. 3. Спектр оптической плотности культуры A. platensis при светодиодном освещении 5 клк
Fig. 3. Absorption spectrum of A. platensis culture under LED illumination of 5 klx
Первым шагом необходимо определить спектр культуры с учётом длины оптического пути L по формуле (4):
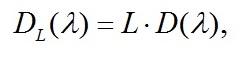 |
(4)
|
где D(λ) – спектр культуры для каждой длины волны из области ФАР.
Используя соотношение, выведенное из закона Бугера-Ламберта-Бера, определим пропускание (5) и коэффициент поглощения (6) для каждого значения длин волн:
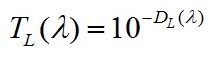 |
(5)
|
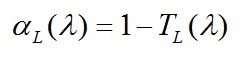 |
(6)
|
Далее определим долю поглощения световой энергии для каждого значения длины волны:
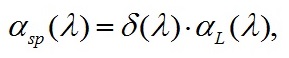 |
(7)
|
где δ(λ) – доля энергии, приходящаяся на каждую длину волны энергетического спектра лампы в области ФАР, определяемая по формуле:
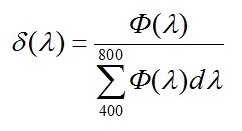 |
(8)
|
В результате, подставив данные, полученные (4) – (8), в (3), определим коэффициент поглощения световой энергии во всей области ФАР для каждой из длин волн диапазона 400–800 нм:
Для определения количества поглощенной энергии переведём фотометрические единицы освещённости в единицы энергетического количества. Для этого используем соотношение (Геворгиз, Шматок, Лелеков, 2005; Геворгиз, Малахов, 2018):
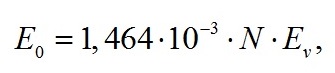 |
(9) |
где E0 – облучённость, Вт/м2; Eᵥ – освещённость поверхности, лк; N – отношение величин полной и определяемой люксметром световой энергии, рассчитанная по методике (Геворгиз, Малахов, 2018).
Для получения величины N (отношение величин полной и видимой человеческим глазом световой энергии источника освещения) необходимо составить таблицу из значений длин волн (λ) от 400 до 800 нм, величин излучаемой энергии, соответствующих этим длинам волн (Ф(λ)), которые были получены в результате оцифровки графика энергетического спектра излучения светодиодной или люминесцентной лампы. Далее добавить значения относительной спектральной световой эффективности (видность) (V(λ)), которые соответствуют значениям длин волн. С помощью этих данных необходимо воспроизвести интерполяцию и найти промежуточные значения относительной видности. Затем, перемножив каждые значения излучаемой энергии Ф(λ) и спектральной световой эффективности V(λ), получить спектр видности лампы (Ф(λ)·V(λ)). Просуммировав все значения Ф(λ) и Ф(λ)·V(λ) и, найдя их отношение получим N:
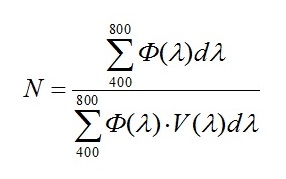 |
(10) |
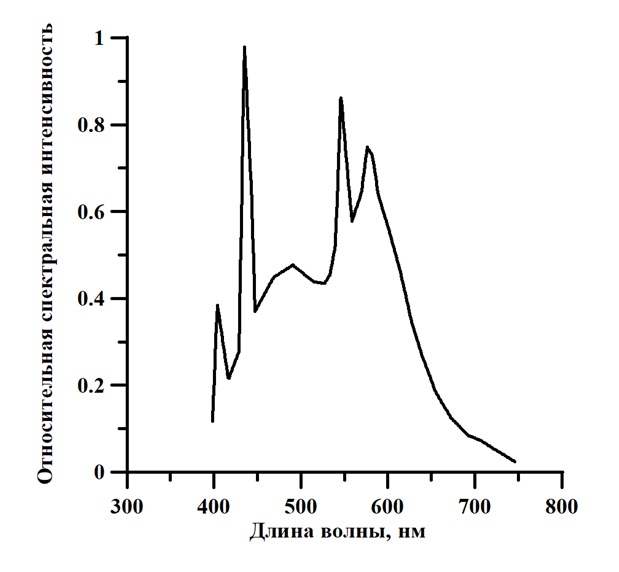
Рис. 4. Спектр люминесцентной лампы Philips Daylight TL-D 54-765 6G мощностью 18 Вт
Fig. 4. The spectrum of the Philips Daylight TL-D 54-765 6G fluorescent lamp with a power of 18 watts
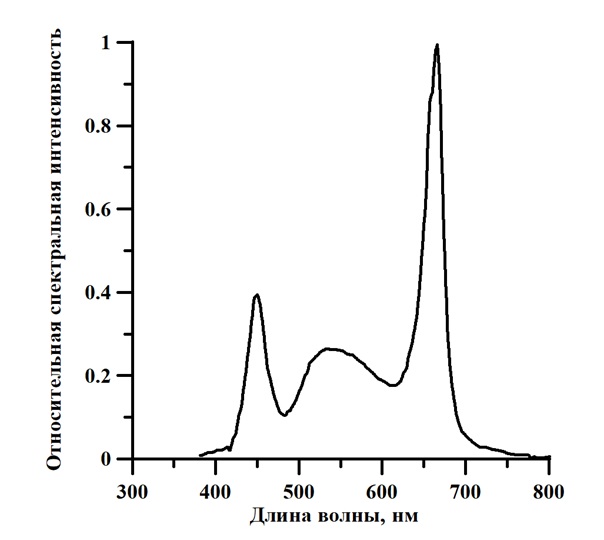
Рис. 5. Спетр светодиодной лампы LCD Feron LB-213 мощностью 10 Вт
Fig. 5. Spectrum of the LED Feron LB-213 LED lamp with a power of 10 watts
Величина запасённой энергии Ех определяется произведением прироста биомассы и её калорийностью R, в среднем составляющая около 5 ккал или 20,86 кДж в 1 г биомассы микроводорослей (Белянин, 1980), т. е:
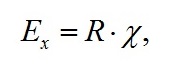 |
(11)
|
где χ – прирост, зависящий от продуктивности (P) и объёма культуры (V):
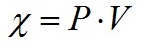 |
(12)
|
Окончательно выражение для определения КПД фотобиосинтеза культуры (1) можно представить с учётом (2) – (12) в виде:
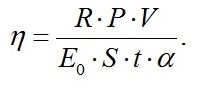 |
(13)
|
Рассмотрим пример расчета КПД фотобиосинтеза для 5 клк светодиодного источника освещения.
В результате оцифровки графика энергетического спектра излучения светодиодной лампы (рис. 4) получим значения излучаемой энергии Ф(λ) и спектральной световой эффективности V(λ), затем спектр видности лампы (Ф(λ)·V(λ)).
Просуммировав все значения Ф(λ) и Ф(λ)·V(λ), находим N для светодиодного источника по формуле (10):
N = 3,10
Далее, подставляя полученное значение N и величину освещённости 5 клк рабочей поверхности культиватора в формулу (9), была найдена облучённость Ee:

Для определения КПД фотобиосинтеза были взяты расчёты величин поглощённой световой энергии (Eп) и запасённой энергии (Ex).
Поглощённая энергия определена по формуле (2):
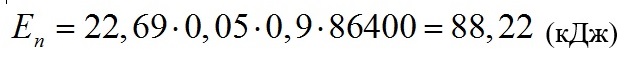
Учтём, что в (12) прирост зависит от объёма и продуктивности, однако в условиях эксперимента, где V=1 л, получим χ=P. Тогда запасённая энергия, определённая по формуле (11):
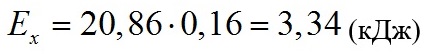
Подставляя все полученные значения в формулу для КПД (1), получаем:
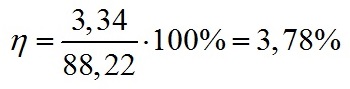
Это значит, что эффективность преобразования световой энергии в энергию химических связей внутри клетки составляет 3,78% при светодиодном освещении 5 клк.
Аналогичные расчёты проведены и для других опытных вариантов с другими условиями культивирования. Результаты расчетов представлены в Таблице 2.
Таблица 2. Значения основных параметров для расчёта КПД при различных источниках освещения
Table 2. Values of the main parameters for calculating the efficiency for various lighting sources
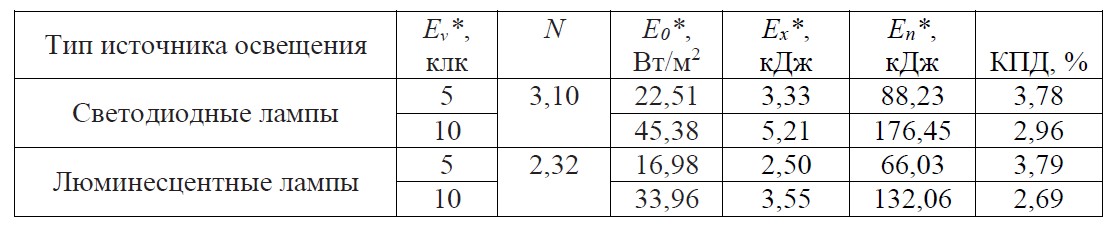
Примечание: Eᵥ* – освещённость; E0* – мощность энергии ФАР, приходящаяся на рабочую поверхность фотобиореактора; Ex* и Eп* – запасённая и поглощённая энергии.
Анализируя таблицу, можно сделать вывод, что максимальные значения КПД (3,78% и 3,79%) достигнуты при освещённости 5 клк как для светодиодного источника освещения, так и для люминесцентного, несмотря на то что значения облучённости были минимальны и зависели от спектрального состава каждой из ламп. Также следует отметить, что максимальная продуктивность (0,25 г СВ·л-1·сут-1) была получена при светодиодном освещении на 10 клк, т.е. на 45 Вт/м2, что соответствует максимальному значению энергии, приходящейся на поверхность фотобиореактора, а минимальное значение продуктивности (0,12 г СВ·л-1·сут-1) получено при люминесцентном освещении на 5 клк (17 Вт/м2), т.е. минимальном значении энергии. Максимальная скорость роста (1,13 сут-1) была достигнута при люминесцентном освещении на 10 клк (34 Вт/м2), а минимальная (0,62 сут-1) – при диодном на 5 клк (22,5 Вт/м2).
Разница в значениях КПД фотобиосинтеза обусловлена различием источников излучения. Известно, что основными пигментами A. platensis являются фикоцианин и хлорофилл, максимумы которых можно наблюдать на спектре культуры, представленном на рис. 3. Как видно из спектра светодиодной лампы (рис. 4) максимумы находятся в пике поглощения хлорофилла (450 нм и 660 нм), а в спектре люминесцентной лампы (рис. 5) максимальные значения наблюдаются в пике поглощения хлорофилла (440 нм) и фикоцианина (600 нм). Фикоцианин, также, как и каротиноиды, являются светопоглощающими соединениями фотосинтезирующих организмов, которые поглощают свет и передают энергию на главный пигмент фотосистемы – хлорофилл а. У этого процесса также есть КПД. Эффективность переноса энергии от каротиноидов к хлорофиллу составляет около 40% (Холл, 1983). При использовании света синей части спектра КПД фотосинтеза будет принимать минимальное значение, так как процесс передачи энергии хлорофиллу должен проходить на 680 нм, т.е. на красной части спектра. При использовании источников освещения различных типов соотношения пиков поглощения между каротиноидами, хлорофиллом и фикоцианином будут различными. Взаимосвязь пигментов, с учётом передачи энергии между ними, определяет эффективность в целом.
Заключение
Исходя из вышеперечисленного, можно сказать, что продукционные характеристики A. platensis, а именно продуктивность на линейном участке и КПД фотобиосинтеза, в большей степени зависят не от спектрального состава источников освещения, а от количества энергии, приходящейся на поверхность культиватора. Это также подтверждается в работе (Гаврилов и др., 2018) по сравнению спектрального состава различных светодиодных ламп: тёплый и холодный светодиод, а также фитосветодиод. Максимальное значение КПД (6,47%) было достигнуто при тёплом светодиоде, при минимальной облучённости 23 Вт/м2. Полученные значения КПД фотобиосинтеза при 5 клк светодиодного и люминесцентного освещения оказались близки. Это свидетельствует о том, что не важно какой тип источника освещения использовать. Рассматривая монографию (Тренкеншу, 2005) можно сказать, что с промышленной точки зрения необходимо проводить исследования при некотором оптимальном значении облучённости, в котором скорость роста культуры и КПД фотобиосинтеза принимают наиболее благоприятные значения. Следует отметить, что спектральный состав источника излучения не влияет на качественный состав фотосинтетических пигментов, однако, будет влиять на их концентрацию (Козел и др., 2015).
Работа выполнена в рамках Госзадания по теме НИР ФИЦ ИнБЮМ № 121030300149-0.
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Список литературы
- Антонов В.Ф., Черныш A.M., Пасечник В.И., Вознесенский С.А., Козлова Е.К. Биофизика. – М.: ВЛАДОС, 1999. – 288 с.
- Белянин В.Н., Сидько Ф.Я., Тренкеншу А.П. Энергетика фотосинтезирующей культуры микроводорослей. – Новосибирск: Наука, 1980. – 134 с.
- Гаврилов П.Е., Костылев А.А., Лелеков А.С., Малахов А.С. Продуктивность и КПД фотобиосинтеза Spirulina (Arthrospira) platensis при различном спектральном составе светодиодного излучения // Актуальные вопросы биологической физики и химии. 2018. Т. 3, № 3. С. 535–540.
- Геворгиз Р.Г., Алисиевич А.В., Шматок М.Г. Оценка биомассы Spirulina platensis (Nordst.) Geitl. по оптической плотности культуры // Экология моря. 2005. Т. 70. С. 96–106.
- Геворгиз Р.Г., Малахов А.С. Пересчёт величины освещённости фотобиореактора в величину облучённости. – Севастополь: ООО «Колорит», 2018. – 60 с.
- Геворгиз Р.Г., Шматок М.Г., Лелеков А.С. Расчёт КПД фотобиосинтеза у низших фототрофов. 1. Непрерывная культура // Экология моря. 2005. Т. 70. С. 31–36.
- Козел Н.В., Доманский В.П., Мананкина Е.Е., Адамчик К.О., Дремук И.А, Савина С.М. Влияние спектрального состава светодиодного излучения на структуру фотосинтетического аппарата Spirulina platensis // Весці Нацыянальнай акадэміі навук Беларусі. 2015. №2. С. 44–49.
- Пехов А.П. Биология с основами экологии. – СПб.: Издательство «Лань», 2000. – 672 с.
- Справочная книга по светотехнике // Ю.Б. Айзенберга (ред.). – М.: Энергоатомиздат, 1983. – С. 472.
- Тренкеншу Р.П. Кинетика субстратзависимых реакций при различной организации метаболических систем. – Севастополь: ЭКОСИ–Гидрофизика, 2005. – 89 с.
- Тренкеншу Р.П., Лелеков А.С. Моделирование роста микроводорослей в культуре. – Севастополь: ООО «Константа», 2017. – 152 с.
- Тренкеншу Р.П., Лелеков А.С., Боровков А.Б., Новикова Т.М. Унифицированная установка для лабораторных исследований микроводорослей // Вопросы современной альгологии. 2017. №1 (13). URL: http://algology.ru/1097 (дата обращения: 10.10.2021)
- Тренкеншу Р.П., Лелеков А.С., Новикова Т.М. Линейный рост морских микроводорослей в культуре // Морской биологический журнал. 2018. Т. 3, №1. С. 53–60. DOI: https://doi.org/10.21072/mbj.2018.03.1.06
- Хит О. Фотосинтез. (Физиологические аспекты). – М.: Мир, 1972. – 316 с.
- Холл Д., Рао К. Фотосинтез. – М.: Мир, 1983. – 134 с.
- Чекушкин А.А., Гудвилович И.Н., Лелеков А.С. Продукционные характеристики Spirulina platensis и Dunaliella salina в Севастопольском регионе в осенний период // Вопросы современной альгологии. 2019. №1 (19). С. 96–104. URL: http://algology.ru/1435 (дата обращения: 10.10.2021) DOI: https://doi.org/10.33624/2311-0147-2019-1(19)-96-104
- Zarrouk C. Contribution à l’étude d’une cyanophycée. Influence de divers facteurs physiques et chimiques sur la croissance et la photosynthèse de Spirulina maxima (Setch et Gardner) Geitler: Ph. D thèse. – Paris, 1966. – 114 p.
Статья поступила в редакцию 15.10.2021
После доработки 11.11.2021
Статья принята к публикации 18.11.2021
Об авторах
Клочкова Виктория Сергеевна − Viktoria S. Klochkova
студент, Севастопольский государственный университет, Севастополь, Россия (Sevastopol State University, Sevastopol, Russia); кафедра «Физика»
viki-iki@mail.ru
https://orcid.org/0000-0002-2120-9589
Богачёва Елизавета Андреевна – Elizaveta A. Bogacheva
студент, Севастопольский государственный университет, Севастополь, Россия (Sevastopol State University, Sevastopol, Russia); кафедра «Физика»
bogacheva007@gmail.com
https://orcid.org/0000-0001-8856-6815
Лелеков Александр Сергеевич – Alexander S. Lelekov
кандидат биологических наук
старший научный сотрудник, ФИЦ «Институт биологии южных морей имени А.О. Ковалевского РАН», Севастополь, Россия (A.O. Kovalevsky Institute of Biology of the Southern Seas of RAS, Sevastopol, Russia)
a.lelekov@yandex.ru
https://orcid.org/0000-0003-1213-7963
ССЫЛКА:
Клочкова В.С., Богачёва Е.А., Лелеков А.С. Влияние спектрального состава света на продукционные характеристики культуры Arthrospira (Spirulina) platensis // Экология гидросферы. 2021. №1 (6). С. 49–60. URL: http://hydrosphere-ecology.ru/222
DOI – https://doi.org/10.33624/2587-9367-2021-1(6)-49-60
При перепечатке ссылка на сайт обязательна
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
Адрес - info@hydrosphere-ecology.ru
Effect of spectral composition of light on the production characteristics of Arthrospira (Spirulina) platensis
Viktoria S. Klochkova1, Elizaveta A. Bogacheva1, Alexander S. Lelekov2
1Sevastopol State University (Sevastopol, Russia)
2Kovalevsky Institute of Marine Biological Research of RAS (Sevastopol, Russia)
The study of the growth of the batch culture of Spirulina platensis with different spectral composition of LED and luminescent radiation in plane-parallel photobioreactors was carried out. In the experiments, we used LED lamps LCD Feron LB-213 10 W, as well as fluorescent lamps TDM Electric 18 W. It has been shown that the maximum productivity of A. platensis does not depend on the radiation spectrum and is 0,25 g·l-1·day-1 at an energy of 45 W·m-2. In the linear phase of growth, the efficiency of light energy conversion (efficiency of photobiosynthesis) was calculated, taking into account that the culture absorbs 90% of the incident light: the maximum value was obtained for LED and fluorescent lighting (23 W·m-2 and 17 W·m-2 respectively), which turned out to be the same and amounted to about 3,78 %. The minimum efficiency of 2,69% is obtained with fluorescent lighting at 34 W·m-2.
Key words: maximum productivity; efficiency of photobiosynthesis; specific growth rate; spectral composition.
References
- Antonov V.F., Chernysh A.M., Pasechnik V.I., Voznesenskij S.A., Kozlova E.K. Biofizika [Biophysics]. VLADOS, Moscow, 1999. 288 p. (in Russ.)
- Belyanin V.N., Sid'ko F.Ya., Trenkenshu R.P. Energetika fotosinteziruyushchej kul'tury mikrovodoroslej [Energetics of photosynthetic culture of microalgae]. Nauka, Novosibirsk, 1980. 134 p.
- Chekushkin A.A., Gudvilovich I.N., Lelekov A.S. Production characteristics of Spirulina platensis and Dunaliella salina cultures in the Sevastopol region at the off-season. Voprosy sovremennoi algologii [Issues of modern algology)]. 2019. No. 1 (19). P. 96–104. URL: http://algology.ru/1435. DOI: https://doi.org/10.33624/2311-0147-2019-1(19)-96-104 (date: 10.10.2021) (in Russ.)
- Gavrilov P.E., Kostylev A.A., Lelekov A.S., Malahov A.S. The productivity and efficiency of photobionts Spirulina (Arthrospira) platensis under different spectral composition of the led emission. Topical issues of biological physics and chemistry. 2018. V.3. No. 3. P. 535–540. (in Russ.)
- Gevorgiz R.G., Alisievich A.V. SHmatok M.G. Estimation of biomass Spirulina platensis (Nordst.) Geitl with use of optical density of culture. Ekologiya moray [Ecology of the Sea]. 2005. No. 70. P. 96–106. (in Russ.)
- Gevorgiz R.G., Malahov A.S. Pereschyot velichiny osveshchyonnosti fotobioreaktora v velichinu obluchyonnosti [Recalculation of the photobioreactor illumination value into the irradiance value]. LLC “Kolorit”, Sevastopol, 2018. 60 p. (in Russ.)
- Gevorgiz R.G., Shmatok M.G. Lelekov A.S. Calculation coefficient of efficiency photobiosynthesis at lower phototrophs. 1. Continuous culture Ekologiya moray [Ecology of the Sea]. 2005. No. 70. P. 31–36. (in Russ.)
- Hit O. Fotosintez. (Fiziologicheskie aspekty) [Photosynthesis. (Physiological aspects)] Mir, Moscow, 1972. 316 p. (in Russ.)
- Holl D., Rao K. Fotosintez [Photosynthesis]. Mir, Moscow, 1983. 134 p. (in Russ.)
- Kozel N.V., Domanskii V.P., Manankina E.E., Adamchyk K.O., Dremuk I.A., Savina S.M. The influence of the spectral composition of the LED lighting on the structure of the photosynthetic apparatus of Spirulina platensis. Izvestiya Nacional'noj akademii nauk Belarusi [Bulletin of the National Academy of Sciences of Belarus]. 2015. No. 2. P. 44–49. (in Russ.)
- Pekhov A.P. Biologiya s osnovami ekologii [Biology with the basics of ecology]. Publishing House “Lan”, St. Petersburg, 2000. 672 p. (in Russ.)
- Spravochnaya kniga po svetotekhnike [Reference book on lighting engineering]. Energoatomizdat, Moscow, 1983. 472 p. (in Russ.)
- Trenkenshu R. P., Lelekov A. S., Borovkov A. B., Novikova T. M. Unified installation for microalgae laboratory studies. Voprosy sovremennoi algologii [Issues of modern algology]. 2017. No. 1 (13). URL: http://algology.ru/1097 (date: 10.10.2021) (in Russ.)
- Trenkenshu R.P. Kinetika substratzavisimyh reakcij pri razlichnoj organizacii metabolicheskih system [Kinetics of substrate-dependent reactions in different organization of metabolic systems]. EKOSI-Hydrophysics, Sevastopol. 2005. 89 p. (in Russ.)
- Trenkenshu R.P., Lelekov A.S. Modelirovanie rosta mikrovodoroslej v kul'ture [Modeling of microalgae growth in culture]. LLC “Constant”, Sevastopol, 2017. 152 p. (in Russ.)
- Trenkenshu R.P., Lelekov A.S., Novikova T.M. Linear growth of marine microalgae culture. Marine Biological Journal. 2018. V.3. No. 1. P. 53–60. DOI: https://doi.org/10.21072/mbj.2018.03.1.06 (in Russ.)
- Zarrouk C. Contribution à l’étude d’une cyanophycée. Influence de divers facteurs physiques et chimiques sur la croissance et la photosynthèse de Spirulina maxima (Setch et Gardner) Geitler: Ph. D thèse. – Paris, 1966, 114 p. (in French)
Authors
Klochkova Viktoria S.
Sevastopol State University, Sevastopol, Russia
viki-iki@mail.ru
https://orcid.org/0000-0002-2120-9589
Bogacheva Elizaveta A.
Sevastopol State University, Sevastopol, Russia
bogacheva007@gmail.com
https://orcid.org/0000-0001-8856-6815
Lelekov Alexander S.
Kovalevsky Institute of Biology of the Southern Seas of RAS, Sevastopol, Russia
a.lelekov@yandex.ru
https://orcid.org/0000-0003-1213-7963
ARTICLE LINK:
Klochkova V.S., Bogacheva E.A., Lelekov A.S. Effect of spectral composition of light on the production characteristics of Arthrospira (Spirulina) platensis. Hydrosphere Ecology. 2021. №1 (6). P. 49–60. URL: http://hydrosphere-ecology.ru/222
DOI – https://doi.org/10.33624/2587-9367-2021-1(6)-49-60
When reprinting a link to the site is required
Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free.
Address - info@hydrosphere-ecology.ru
На ГЛАВНУЮ
К разделу ПУБЛИКАЦИИ
|
 |
Эл № ФС77-61991 от 2 июня 2015 г.
ISSN 2587-9367
Издатель -
Камнев Александр Николаевич.
Адрес издательства - 123298,
г. Москва, ул.Берзарина, д.16.
|





















